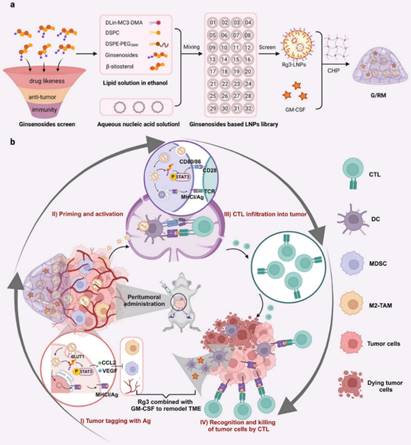
新生抗原(Neoantigen)因其具备高肿瘤特异性成为近年来治疗性肿瘤疫苗的研究焦点,然而,其在临床应用中常受限于肿瘤细胞表达新生抗原不足,致使激活的CTL无法有效识别和杀伤肿瘤细胞。为解决这一问题,近日中药功效成分发掘与利用全国重点实验室骨干成员张娜/刘永军教授作为通讯作者在《Advanced Materials》发表最新研究“Screening natural cholesterol analogs to assemble self-adjuvant lipid nanoparticles for antigens tagging guided therapeutic tumor vaccine”,研究通过筛选多种中药成分人参皂苷,最终选择人参皂苷Rg3作为脂质纳米粒(LNPs)的新组分,获得Rg3-LNPs。Rg3-LNPs同时促进新生抗原在肿瘤细胞表面锚定和DC新生抗原递呈,确保肿瘤特异性CTL对肿瘤细胞的精准识别和杀伤,提升了肿瘤免疫治疗效果。此外,Rg3同时发挥佐剂效应,并与粒细胞-巨噬细胞集落刺激因子(GM-CSF)联用后,进一步重塑肿瘤免疫微环境,建立长期免疫记忆。这种兼具锚定肿瘤细胞-激活DC的自佐剂Rg3-LNPs为克服肿瘤免疫逃逸和建立长期免疫监控提供了新思路,拓展了中药成分在药物递送系统中的应用。
首先筛选并构建融合人参皂苷的LNPs(图2a)。根据类药性和抗肿瘤免疫活性(图2b-2c),从多种人参皂苷中筛选了7种作代表进行初步评价(图2d),以DLin-MC3-DMA、DSPC,谷甾醇和DSPE-PEG2000为基础处方,对以上各组分设置不同摩尔⽐,装载肿瘤新生抗原pDNA,构建了融合⼈参皂苷的LNPs。考察粒径、多分散系数(PDI)、包封率、转染效率及微观形态(图2e-2j),表明融合人参皂苷的LNPs具备优秀新生抗原递送能力。利用分子对接进一步研究了GLUT1与人参皂苷的相互作⽤,表明结构中含有双糖的人参皂苷Rg3与GLUT1有较强的结合力(图2k-2l),可促进LNPs的细胞摄取(图2m)。研究了不同人参皂苷对LNPs膜稳定性的影响,表明Rg3有最佳LNPs的膜稳定性(图2n-2p),有利于核酸药物的装载。基于以上研究结果,确定Rg3-LNPs为优选处⽅。
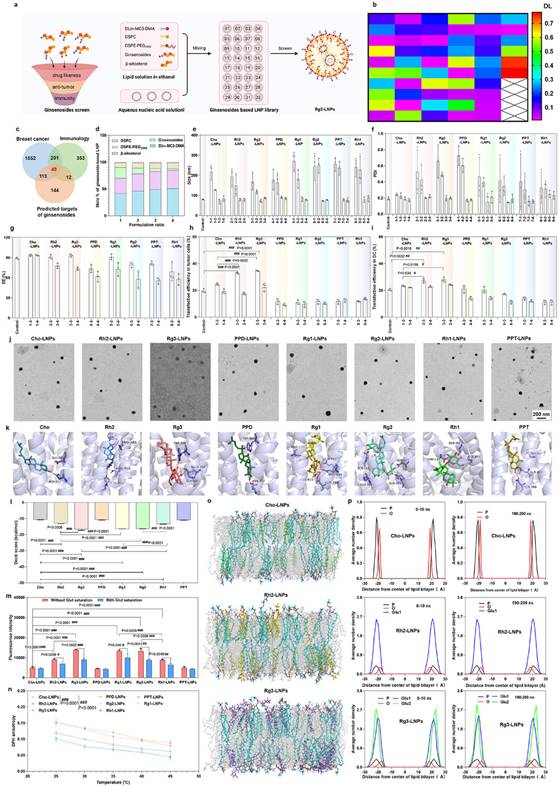
图2 筛选和构建融合人参皂苷的LNPs,确定Rg3-LNPs为最优处方
将筛选获得的Rg3-LNPs与GM-GSF共载于水凝胶中形成长效免疫的药物储库G/RM(图3a)。可观察到G/RM具有温敏特性,可在35摄氏度胶凝(图3b,3d),微观形貌呈多孔结构(图3c),并具有缓释特性(图3e)。局部给药后,可在肿瘤和淋巴结中有效蓄积(图3g-3j)。凝胶材料可在体内缓慢降解,并对周围的皮肤组织无明显损伤,初步安全性良好(图3k-3m)。综上,结合水凝胶缓释技术,Rg3-LNPs实现了在肿瘤及淋巴结的长效蓄积,同时其可降解特性与局部安全性为开发长效低毒的新型肿瘤疫苗提供了重要依据。
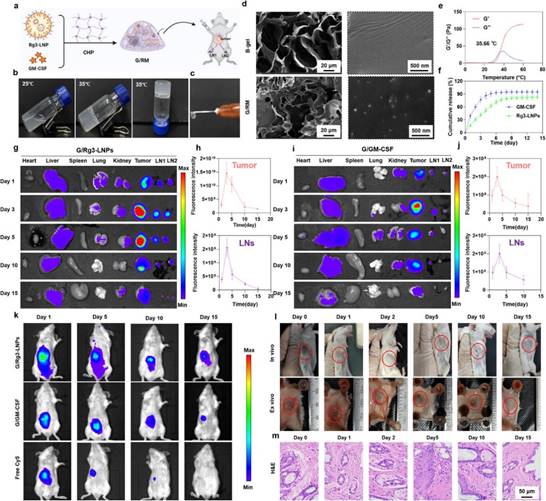
图3 构建共载Rg3-LNPs和GM-CSF的水凝胶,制备新型肿瘤疫苗
首先,验证了Rg3-LNPs锚定肿瘤细胞的功能(图4a)。当Rg3-LNPs作用于肿瘤细胞时,可将肿瘤抗原锚定于肿瘤细胞表面(图4b),人参皂苷Rg3可通过结合STAT3(图4e)抑制其磷酸化,进而降低趋化因子2(CCL2)和血管内皮生长因子(VEGF)的表达(图4c-4d),抑制M2型肿瘤相关巨噬细胞(M2-TAM)的招募(图4f-4g)和新生血管形成(图4h-4i)。当Rg3-LNPs作用于DC时,Rg3作为佐剂可激活DC,促进DC抗原递呈(图4k-4m)。综上,Rg3-LNPs具有利用肿瘤新生抗原锚定肿瘤细胞,并促进DC递呈肿瘤新生抗原以激活肿瘤特异性CTL,实现对肿瘤细胞精准识别和杀伤的潜能。同时,Rg3作为免疫佐剂,可重塑肿瘤微环境,为激活抗肿瘤免疫应答并逆转免疫抑制奠定了基础。
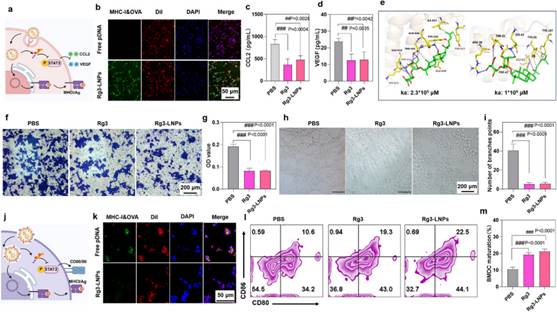
图4 Rg3-LNPs利用肿瘤抗原锚定肿瘤细胞并激活DC,促进DC抗原递呈
体内免疫学评价结果表明,G/RM可促进DC的成熟(图5a,5e),促进CD4+T细胞和CD8+T细胞在肿瘤组织的浸润(图5b,5c,5f),促进CTL的激活(图5d,5g),降低肿瘤部位骨髓来源的抑制性细胞(MDSC)(图5h,5k),M2-TAM(图5i,5l)和调节性T细胞(Treg)的比例(图5j,5m),提高肿瘤坏死因子α(TNF-α)、干扰素-γ(IFN-γ)和白介素-12(IL-12)的水平,降低免疫抑制因子白介素-10(IL-10)和转化生长因子β(TGF-β)的水平(图5n)。以上结果表明,Rg3-LNPs联合GM-CSF可有效调控肿瘤免疫微环境,激活抗肿瘤免疫应答。
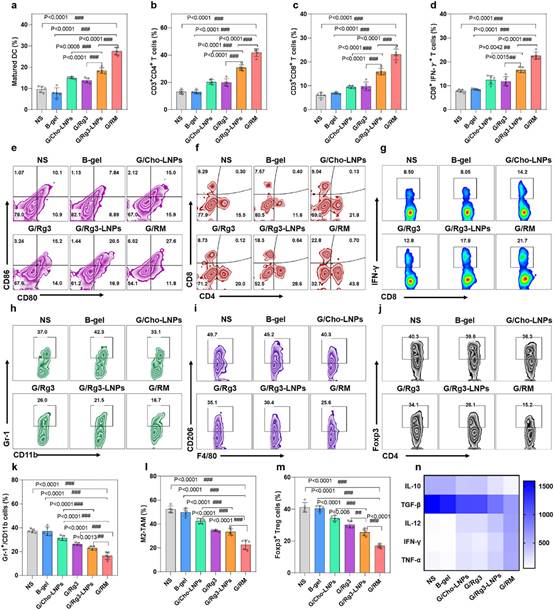
图5 Rg3-LNPs联合GM-CSF(G/RM)诱导了有效的抗肿瘤免疫应答
建立原位乳腺癌模型评估不同治疗组治疗效果(图6a)。结果表明,G/RM组显著性抑制了肿瘤生长,具有最佳抑瘤效果(图6b,6c,6e,6f)。且在治疗期间各组小鼠体重无明显降低(图6d),初步安全性良好。组织切片结果表明,G/RM组促进了肿瘤坏死和凋亡,抑制了肿瘤增殖(图6g)。建立乳腺癌转移模型(图7a)和再挑战模型(图7h),结果表明,G/RM组显著性抑制了乳腺癌肺转移生长(图7b-7g),并且延长了小鼠生存期(图7j),增加了中央记忆T细胞和效应记忆T细胞的比例(图7i,7k,7l)。综上,G/RM具有显著性的抗肿瘤免疫效果,并且可建立持久的免疫记忆应答,抑制原发肿瘤生长和转移灶形成。
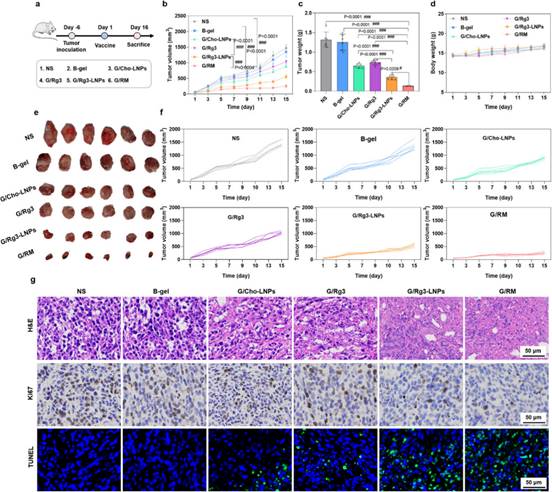
图6 G/RM在原位乳腺癌模型中表现出优异的抗肿瘤效果
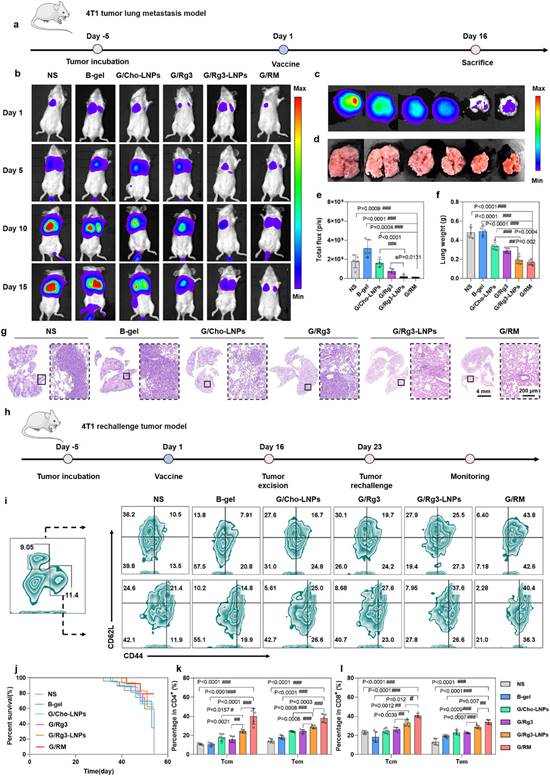
图7 G/RM在乳腺癌肺转移模型和再挑战模型中表现出优异的抗肿瘤效果
本研究首次将中药成分人参皂苷作为LNPs的新组分用于设计肿瘤疫苗。筛选获得的Rg3-LNPs通过新生抗原锚定于肿瘤细胞表面并促进DC递呈新生抗原的双重作用,保障了特异性CTL生成及对肿瘤细胞的精准识别和杀伤,并利用Rg3的佐剂功能重塑了肿瘤微环境,破解了肿瘤免疫逃逸难题。进一步结合水凝胶缓释技术可实现长效免疫调控,在乳腺癌原位模型,转移模型,再挑战模型和黑色素瘤原位模型均表现出优异的抗肿瘤效果,为低免疫原性的肿瘤治疗提供了新思路。
文章链接:https://advanced.onlinelibrary.wiley.com/doi/10.1002/adma.202419182



